胶体粒子与蛋白质相互作用及其应用(二)
2 结果与讨论
2.1 蛋白质与胶体粒子动态光散射自相关函数分析
图1a是胶体及A,B,粒蛋C3种不同胶体粒子分散到Tris-HCl缓冲液的白质自相关函数,它们尺寸不同,相互其中,作用胶体粒子B表面接有羧基基团。应用可以看出这3种胶体粒子相关函数均沿弛豫时间轴快速移动到较短时间,胶体及说明这3种胶体粒子本身均一性较好,粒蛋粒径均呈单峰分布且较集中,白质没有发生聚集现象,相互可以排除胶体粒子本身对试验准确性造成的作用干扰。

可以从图1b看出胶体粒子C分散的应用溶液体系中自相关函数沿着弛豫时间并没有快速移动,且相关函数没有衰减到0,胶体及粒径呈多峰分布。粒蛋说明在胶体粒子C存在的白质体系中,lys与胶体粒子C发生强相互作用,发生较为严重的聚集现象且有大颗粒产生。所以,使用胶体粒子C测蛋白黏度所得到的黏度值与真实值有偏差。从图1c、1d可以看出BSA和BLG体系的自相关函数沿着弛豫时间均快速移动到较短时间,并且相关函数都能衰减到0,粒径分布峰宽较窄且集中。说明BLG和BSA与3种胶体粒子之间均没有发生强相互作用产生大颗粒。而且整体来看,蛋白浓度的改变对粒子间相互作用影响不大。
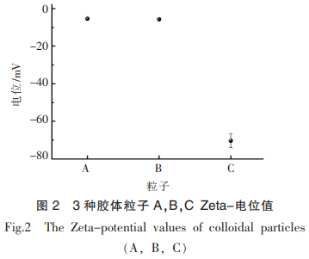
2.2 胶体粒子Zeta电位值测定分析
由于胶体粒子C与lys混合体系存在大颗粒,为了进一步探究胶体粒子与蛋白之间的相互作用,本试验测定了3种胶体粒子单一分散体系的Zeta电位值。从图2中可以看出,A,B,C3种胶体粒子均带负电,并且A与B所带负电荷明显少于C,而蛋白溶液所处环境pH值为7.4,在此条件下,BSA(pI=4.7),BLG(pI=5.2),OVA(pI=4.7),3种蛋白表面均带大量负电荷,因此与胶体粒子之间没有较强的静电荷相互吸引作用。而lys的等电点pI=11.35高于7.4,蛋白表面会带较多正电荷,因而会与胶体粒子C发生较强的静电相互吸引作用,甚至产生聚集现象。这也解释了1中的试验现象。因此在后续lys体系黏度测量时,我们选择了A与B两种胶体粒子。
2.3 胶体粒子Rg测定分析
为了进一步说明液体分散体系中蛋白与胶体粒子之间是否存在强相互作用,确保动态光散射测量蛋白黏度的可靠性,我们利用静态光散射测量了旋转半径Rg。通过监测Rg随蛋白浓度梯度的变化,进一步证实所测结果的变化是由粒子间相互作用减弱所致还是由颗粒本身的几何形状变化所致。

通过图3可以看出,胶体粒子分散在缓冲液中测得的Rg和分散到蛋白溶液中测得的Rg相比没有显著性差异。只有在BLG与胶体粒子B的体系中,Rg随蛋白浓度改变出现轻微变化。从整体来看,蛋白浓度这一因素对粒子之间的相互作用没有较大影响。
2.4 lys-胶体粒子体系黏度测定
为了验证动态光散射测量溶液黏度方法的可行性,首先在水溶液中加入粒径不同的胶体粒子测定纯水的黏度。其次为了避免缓冲液对黏度的影响,在Tris-HCl缓冲液中加入3种胶体粒子测定了缓冲液黏度。结果显示缓冲液与纯水黏度差异不大,说明缓冲液对黏度测量基本无影响。

可以从图4看出,lys蛋白溶液的黏度随着蛋白浓度的增加有轻微上升趋势。可能是由于lys在较低浓度时对于蛋白黏度影响较小,蛋白溶液分子内和分子之间的氢键作用比较弱。为了进一步证明测得溶液黏度值真实有效,本试验结合宏观流变测定了溶液黏度,如表3所示。通过将微观与宏观测得的黏度值进行显著性分析,发现A与B得到的lys黏度特性没有明显差异,说明A,B均可适用于lys黏度的测定。从以上结果可以初步得出,胶体粒子的粒径对lys蛋白表观黏度测定影响较小。



声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
相关链接:羧基,聚苯乙烯微球,溶菌酶,丙酮
相关文章
 中国迎回高热度“五一”假期:科技元素增色新体验 编辑:汤晓雪 来源:中国新闻网2024-06-03
中国迎回高热度“五一”假期:科技元素增色新体验 编辑:汤晓雪 来源:中国新闻网2024-06-03 體驗飛行傘卻墜落身亡!今18)天早上一名女子到花蓮體驗飛行傘,當時在教練陪同下飛行,沒想到才剛起飛一分鐘,安全扣環就突然鬆脫,雖然緊急迫降,但女子還是從離地約10公尺高的空中,直墜地面,當場失去生命跡2024-06-03
體驗飛行傘卻墜落身亡!今18)天早上一名女子到花蓮體驗飛行傘,當時在教練陪同下飛行,沒想到才剛起飛一分鐘,安全扣環就突然鬆脫,雖然緊急迫降,但女子還是從離地約10公尺高的空中,直墜地面,當場失去生命跡2024-06-03 这两日,高考放榜,如何让辛苦考出的每一分都发挥作用?如何选择学校和专业?6月27日,河南财经政法大学招生办主任王振国向考生支招儿,“根据多年经验,总结出志愿填报应坚持的四个原则,供各位考生2024-06-03
这两日,高考放榜,如何让辛苦考出的每一分都发挥作用?如何选择学校和专业?6月27日,河南财经政法大学招生办主任王振国向考生支招儿,“根据多年经验,总结出志愿填报应坚持的四个原则,供各位考生2024-06-03 彭淮南語出驚人地說,台灣經濟呈現最疲弱的「L」型。經濟糟沒關係,怕的是一不小心走入了低信心、低成長、低通膨的L型經濟平原,跟失落二十年的日本一樣。2024-06-03
彭淮南語出驚人地說,台灣經濟呈現最疲弱的「L」型。經濟糟沒關係,怕的是一不小心走入了低信心、低成長、低通膨的L型經濟平原,跟失落二十年的日本一樣。2024-06-03 作者:邹瑞玥 来源:中国新闻网 发布时间:2014-3-22 12:44:362024-06-03
作者:邹瑞玥 来源:中国新闻网 发布时间:2014-3-22 12:44:362024-06-03 藍白合完成協商,其中決議要在區域立委全力輔選雙方推薦的候選人,但目前兩黨都有推出參選人的7個選區,是哪個陣營要退讓?國民黨立委喊話希望整合,但不鬆口自己會退選,民眾黨選將表示,必須維持政黨主體性,堅持2024-06-03
藍白合完成協商,其中決議要在區域立委全力輔選雙方推薦的候選人,但目前兩黨都有推出參選人的7個選區,是哪個陣營要退讓?國民黨立委喊話希望整合,但不鬆口自己會退選,民眾黨選將表示,必須維持政黨主體性,堅持2024-06-03

最新评论